
“恭喜你,怀孕了!”
“HCG翻倍良好,B超结果也是好的,目前的情况都很顺利~”
当莺歌(化名)听到检查结果时,过去一年多的紧张、害怕、焦虑、恐惧都化为了喜悦和期待。得益于中国科学院院士黄荷凤教授团队创新性的研究成果,这个26岁的姑娘成为了国内第一个应用乳腺癌单基因PGT结合多基因风险评分的综合性评估模型之后,成功妊娠的病例。
2024年11月30日,黄荷凤院士和浙大妇院生殖内分泌科主任朱依敏教授在“2024浙江省出生缺陷防治学术论坛”上正式发布了这个喜讯。

这是国内首次将多基因风险评分用于评估胚胎的遗传性肿瘤风险,也标志着我国在遗传性肿瘤源头防控方面取得了重要进展。
祖孙三代先后诊断出肿瘤疾病,
促使她找寻遗传密码
2023年6月,备孕近一年还没等到好消息的莺歌来到浙大妇院检查。检查结果显示,她有子宫腺肌症,卵巢内还有内异囊肿,诊断为原发不孕。尽管有些麻烦,但是这样的疾病在浙大妇院妇科并不特殊。很快,莺歌就接受了腹腔镜手术,剔除了右侧卵巢囊肿,还接受了腹腔镜下盆腔内异病灶电凝术和腹腔镜下盆腔粘连松解术等治疗。
术后,莺歌确诊为盆腔子宫内膜异位症四期、子宫腺肌病。这也意味着,莺歌如果想要孩子,很可能要依靠辅助生殖技术。
而在浙大妇院生殖内分泌科,像莺歌这样的患者也有很多,她完全不必担心。然而就在2023年7月,另一张诊断书,打断了莺歌的求子之路。
她在浙大妇院外科接受了右乳溢液导管剥离手术,术后病理显示,她患有“导管内乳头状瘤”。
尽管不是恶性肿瘤,但莺歌还是察觉到了危险。因为莺歌的母亲因卵巢癌、乳腺癌做过相应的手术,外婆患有输卵管癌。祖孙三代先后患病,会不会有遗传?
带着这个疑问,莺歌和母亲进行了基因检测,结果提示:母女两人均有BRCA1基因突变。
这个基因算是科学家们的“老熟人”了——20世纪90年代,研究者发现了这种直接与遗传性乳腺癌有关的基因,有BRCA1和BRCA2基因突变者,罹患乳腺癌和卵巢癌的几率都会较普通人提高。
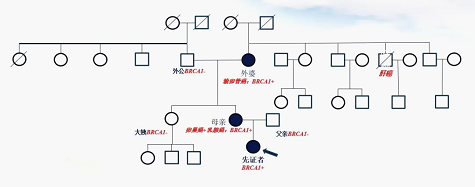
莺歌的肿瘤基因家系图
所以,当莺歌拿到基因检测结果之后,毫不犹豫地,她希望采用第三代试管技术,剔除变异的BRCA1基因,将这个可怕的“炸弹”在自己这一代“拆掉”。
到了这一步,莺歌已经不做他想,准备开始自己的辅助生殖之路。然而,科学家们却还“不满足”。
构建风险评估综合模型,
遗传性肿瘤源头防控实现新突破
我们已经知道,肿瘤的发生具有家族聚集性和遗传易感性,某些基因突变会增加患癌症的风险。比如携带BRCA1和BRCA2基因突变,会使女性70岁以前患乳腺癌的风险分别达到44%-78%和31%-56%。通过第三代试管技术,可以阻断易感基因,让下一代患癌风险降低。
虽然BRCA1和BRCA2等罕见基因变异会增加患乳腺癌的风险,但这些变异只占家族性聚集性乳腺癌病例的一小部分。
全基因组关联研究(GWASs)已经成功地发现了许多与乳腺癌易感性相关的遗传变异位点,但单个变异的风险预测因素的能力有限,多基因风险评分(PRS)可以综合多个易感位点的效应,构建肿瘤风险预测模型,评估个体肿瘤的发生风险。
但是,这样仍然不能排除多基因遗传导致的癌症风险。
【多基因遗传病是指受多对基因控制,同时也受环境因素影响的一类遗传病。常见多基因遗传病有出生缺陷类(唇腭裂、先天性畸形足、先天性幽门狭窄等)、内分泌代谢类(糖尿病、PCOS等)、肿瘤类(家族性肠癌、肺癌等)。】
有没有办法从单基因到多基因,进一步降低癌症风险呢?
黄荷凤院士提出了一个新思路——在辅助生殖过程中,对复杂疾病通过多基因遗传风险评分方法,对胚胎进行多基因疾病遗传风险评估,筛选疾病风险最低的胚胎移植,从而实现多基因遗传病的一级防控。
黄荷凤院士团队已经成功运用这项技术,为慢性病的源头防控提供了可行的创新举措。这一次,在家系验证和生殖伦理均获通过后,团队将从莺歌的案例入手,向遗传性肿瘤的源头防控更进一步。
然而,如何构建能够准确预测疾病发生的多基因风险评分(PRS)模型,成为一大难题。
黄院士提出,基于大规模GWAS数据建立的乳腺癌PRS模型,先对英国生物标本库(UK Biobank)的24.6万名女性对照人群、18,483个女性乳腺癌患病个体进行风险评分算法的测试和验证;再基于东亚人群的位点特异性权重,结合中国人群乳腺癌基因筛查突变位点,对该PRS模型进行校正,构建符合中国人群特异性乳腺癌PRS模型,以克服常规建立的PRS模型在欧洲人群中预测较为准确,而在非欧洲队列中准确性有限的短板。
此外,由于多基因对乳腺癌易感基因赋予的乳腺癌患病风险有修饰作用,因而决定构建结合多基因PRS、乳腺癌易感基因罕见变异和乳腺癌家族史的乳腺癌终生风险评估综合模型。
经过长达数个月的攻关,乳腺癌终生患病风险评估综合模型终于构建完成!
基于该模型,可同时评估胚胎乳腺癌的单基因及多基因致病风险。
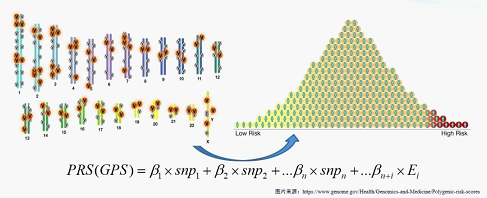
多基因风险评分的过程展示
今年3月,莺歌通过综合模型风险评估的PGT,获得了3枚胚胎;在治疗了子宫内膜相关疾病后,今年11月,莺歌移植了一枚综合评估低风险胚胎并成功怀孕。
这是我国在遗传性肿瘤源头防控方面取得的创新突破,也是黄荷凤院士团队“从生命源头降低慢病、癌症风险,阻断遗传性出生缺陷”之路上的又一大步。
如果家庭中多人患癌
建议进行多基因病风险评估
通过运用综合模型风险评估,可以预测子代患有多基因遗传病的风险,这项技术的广泛应用,将大大提升出生人口质量。对于有家族遗传病(如家族中有多人罹患恶性肿瘤)、又有生育计划的适龄人群来说,用多基因风险评分来评估胚胎的遗传性肿瘤风险,具有非常重要的现实意义。
“某些癌症具有家族聚集性倾向。如果一个家系中较多成员,在相同或不同器官发生恶性肿瘤,就更推荐其在生育前进行风险评估。通过更精准地评估个体的患病风险,将有助于作出正确的风险管理决策。一级预防肿瘤易感子代的出生,可以有效降低家族性肿瘤代代传递的风险,从源头防控出生缺陷。”

黄荷凤院士向媒体介绍这项技术
随着浙江大学医学遗传与发育研究院揭牌启用,黄荷凤院士团队将重点聚焦生殖遗传、发育源性疾病、出生缺陷防控三大研究方向,针对目前存在的发育源性疾病机制不清、无临床预警,以及大多出生缺陷分子病理机制不明、鲜有治愈方法的挑战,就医源性生殖干预的生殖遗传效应、遗传病的早期预警与优生干预、发育源性疾病发生机制及防控、出生缺陷防控等开展研究,继续对其他多基因病开展综合模型风险评估的PGT技术,实现遗传性疾病/发育源性疾病的机制突破和出生缺陷的源头防控。
也祝福更多的家庭,可以从新技术中获益,阻断遗传带来的不利影响,收获健康,收获幸福。


浙公网安备 33010202000574号
版权所有:浙江大学医学院附属妇产科医院 浙ICP备05080900号-1
Copyright © 2016 Women's Hospital School Of Medicine Zhejiang University